Kto naprawi DNA, wywróci świat do góry nogami
Istotne poprawki w tekście składającym się z trzech miliardów „liter”.
Genetycy od lat są w stanie edytować przerwy w DNA. To właśnie pęknięcia są przyczyną wszystkich chorób, a nawet procesu starzenia się organizmu. Metody inżynierii genetycznej, z powodzeniem wdrożone w praktyce, wzbudziły wielki optymizm w światowej społeczności naukowej. W 2020 roku przyznano Nagrodę Nobla za technologię edycji genomu. Co czołowi naukowcy w tej dziedzinie mówią dziś o tej wyjątkowej technologii przyszłości?
Każda żywa komórka ma DNA z tym samym kodem dla jednego organizmu. Komórki w organizmie zmieniają się, a DNA jest stale kopiowane. A sekwencja liter w genomie musi pozostać niezmieniona, aby cały żywy system, taki jak człowiek, mógł nadal istnieć. Ale kopiowanie sekwencji 3 miliardów liter w około 10 bilionach komórek w ludzkim ciele nie może odbywać się bezbłędnie.
Komórki posiadają systemy składające się z białek, które naprawiają błędy i uszkodzenia w DNA, utrzymując w ten sposób stabilność genomu. W każdej komórce naszego ciała mechanizmy naprawy DNA skutecznie naprawiają do miliona uszkodzeń DNA w ciągu zaledwie jednego dnia. Niestety, wystarczy jeden nienaprawiony błąd, który trafi „do obiegu”, aby zapoczątkować poważną chorobę. Dlatego kluczowym tematem w biomedycynie na całym świecie są mechanizmy naprawy DNA i ich regulacja, poprawiająca ich dokładność i wydajność.
Marzenie nagiego kopacza
DNA może zostać uszkodzone przez promieniowanie lub ekspozycję na promieniowanie UV, a także przez inne stresy oksydacyjne (utleniające). Takie jak chemikalia, infekcje, zła ekologia i inne mutagenne czynniki środowiskowe. W ludzkim metabolizmie powstają wolne reaktywne rodniki, które również wpływają na strukturę DNA. Powoduje to powstawanie pojedynczych lub podwójnych pęknięć w nici DNA.
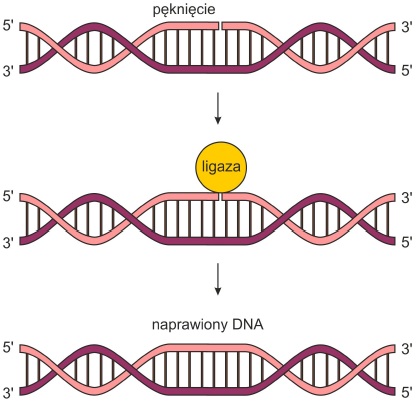
Jednak każda żywa komórka ma własne, bardzo wydajne systemy – białka i enzymy – do naprawy DNA, które wykrywają pęknięcia i łączą końce DNA. Kiedy DNA jest uszkodzone, cykl komórkowy zatrzymuje się i uruchamia się system naprawczy. W tym momencie bardzo ważne jest, aby łączenie końców nie zawiodło i coś innego niż prawidłowa sekwencja tego odcinka łańcucha zostało omyłkowo wstawione do przerwy.
Nieprawidłowe działanie polimeraz DNA jest uważane za najczęstszą przyczynę mutacji w porównaniu z innymi czynnikami. Jeśli błąd nie może zostać skorygowany, aktywowany jest program niszczący wadliwe DNA. Aby nie mogło być kopiowane i tworzyć wadliwych kopii, których obecność może prowadzić do raka. Obecnie na całym świecie bardzo aktywnie bada się. Które enzymy i czynniki białkowe rozpoznają i z większą aktywnością i skutecznością naprawiają niektóre rodzaje przerw w łańcuchu DNA.
W Instytucie Biologii Chemicznej i Medycyny Podstawowej (ICBFM) SB RAS w laboratorium chemii bioorganicznej enzymów pod kierownictwem doktora nauk biologicznych, szefa laboratorium, akademika RAS Olgi Lavrik porównano wydajność systemów naprawczych w komórkach nagiego kreta i normalnej myszy i stwierdzono, że procesy naprawy DNA zachodzą skutecznie u nagiego kreta. Jego żywotność wynosi około 30 lat, podczas gdy jego krewny, zwykła mysz, ma żywotność trzech lat. Ponadto naukowcy odkryli, że nagie krety są praktycznie wolne od raka. Jedynym powodem ich długowieczności i zdrowia jest ich doskonała zdolność do skutecznej naprawy uszkodzonego DNA.
Molekularne nożyczki: zmierz siedem razy.
Dosłowne tłumaczenie akronimu CRISPR to krótkie powtórzenia palindromiczne ułożone w grupy. Te krótkie identyczne odcinki DNA w bakteriach jelitowych japońscy naukowcy odkryli pod koniec lat 80. ubiegłego wieku. Ale nie przywiązywali do nich większej wagi. Ale na pomoc nauce na przełomie tysiącleci pojawiła się bioinformatyka, a analiza genomów znacznie przyspieszyła. Okazało się, że segmenty oddzielające identyczne sekwencje (odstępy) są obcym materiałem genetycznym. Który bakterie pożyczają, gdy wchodzą w kontakt z bakteriofagami zaprojektowanymi w celu ich zniszczenia.
Zamiast ginąć w zetknięciu z wirusem, bakterie pożyczają odcinki jego DNA. A przy kolejnym kontakcie szybko go rozpoznają i niszczą za pomocą specyficznych białek. Metoda ta nazywana jest również systemem odporności adaptacyjnej lub CRISPR-Cas. Cas to białko bakteryjne, które służy jako główne narzędzie w tej technologii. Rozpoznawanie segmentu odbywa się za pośrednictwem matrycowego RNA, a raczej jego niewielkiej części. Oznacza to, że jeśli stworzysz dokładną kopię nieprawidłowej sekwencji w postaci segmentu RNA i wprowadzisz ją do komórki pacjenta. Segment kwasu nukleinowego rozpozna błąd, a białko Cas wytnie go z DNA.
Metoda ta została przyjęta przez genetyków, ponieważ bakteryjny system rozpoznawania wirusów jest niespecyficzny i może rozpoznawać nie tylko DNA wirusa, ale także wszelkie inne odcinki, które „zapamiętały”. Jeśli przeniesiemy cały ten bakteryjny system obronny do komórki ludzkiej lub zwierzęcej, może on rozpoznać niewłaściwe sekwencje, wyciąć i zniszczyć niewłaściwy fragment DNA. Okazuje się, że każda część ludzkiego, zwierzęcego lub roślinnego genomu może zostać wycięta i połączona w razie potrzeby.
W życiu jest inaczej niż w probówce testowej
„Jak każda nowa metoda, CRISPR-Cas ma swoje osobliwości i złożoności, które nie zostały jeszcze rozwiązane. Metoda ta wywołała falę optymizmu i duże nadzieje na jak najszybsze sukcesy w tej dziedzinie. Ale bardzo szybko stało się jasne, że nie wszystko jest takie proste – powiedziała akademik Olga Lavrik. Poważną barierą we wdrażaniu tej technologii jest nadal dostarczanie tych substancji bezpośrednio do chorych komórek pacjenta przez błony komórkowe, które nie są tak łatwe do pokonania”.
Jeśli mówimy o eksperymentach laboratoryjnych, gdy nie ma kwestii bezpieczeństwa dla pacjenta, tak jak w naszym przypadku. Wówczas do komórki wprowadzane są plazmidy (małe koliste DNA), na których zakodowane jest białko Cas9 i niezbędne RNA prowadzące”, wyjaśnia Dmitry Zharkov, kierownik Laboratorium Inżynierii Genomowej i Białkowej w Instytucie Inżynierii Genomowej i Białkowej w Syberyjskim Oddziale Rosyjskiej Akademii Nauk, doktor nauk biologicznych, członek korespondent Rosyjskiej Akademii Nauk, ”Istnieje kilka metod wprowadzania plazmidów do komórki.
Jeśli komórki są pobierane od pacjenta, a celem jest zmiana ich genomu i przeszczepienie ich z powrotem do pacjenta. Wówczas stosowane są dwie opcje. Można wcześniej wymieszać białko Cas9 i prowadzące RNA i wstrzyknąć je do specjalnych cząsteczek liposomowych, które łączą się z komórką. Można też stworzyć specjalnego, bezpiecznego dla człowieka wirusa, który produkuje Cas9 i RNA i wstrzyknąć go do komórek. Dla specjalistów, których zadaniem medycznym jest zmiana genomu komórek wewnątrz pacjenta, tylko wirus jest odpowiedni”.
Enzymy naprawcze DNA znajdują się w jądrze komórek i są kluczem do istnienia wszystkich żywych istot na Ziemi. W międzynarodowej społeczności naukowej temat ten cieszy się dużym zainteresowaniem. A wiele laboratoriów w wiodących ośrodkach naukowych jest zaangażowanych w jego badania, powiedziała akademik Olga Lavrik. Obecnie w wielu przypadkach można już określić, które choroby są spowodowane mutacjami w określonych białkach.
Zastosowanie terapii genowej w praktyce
Większość prac z systemem CRISPR-Cas na całym świecie związana jest z niezwykle szerokimi możliwościami naukowymi. Tworzeniem dowolnych modeli laboratoryjnych i badaniem różnych interakcji. Które można kontrolować i korygować. Dla światowej nauki jest to przede wszystkim metoda badawcza, idealne narzędzie do przewidywania. A następnie projektowania rozwoju niektórych procesów w żywych systemach. Niemniej jednak, kilka nowych metod terapii genowej jest już dziś dostępnych dla pacjentów. Pierwszą terapią genową jest lek voretigene neparvovec (Luxterna). Jest on zatwierdzony do leczenia dystrofii siatkówki związanej z mutacjami w genie RPE65. Innym lekiem opartym na CRISP-Cas przeciwko SMA-1 (rdzeniowy zanik mięśni typu 1) był Zolgensma. Okazał się on również wysoce skuteczny w leczeniu noworodków.
Oczekuje się wielkiego sukcesu tej techniki w leczeniu chorób hematologicznych – anemii sierpowatej i talasemii. Próby kliniczne preparatów, które „wycinają” wadliwą hemoglobinę S i wstawiają „prawidłową” hemoglobinę do DNA dobiegają końca. W tym przypadku edycja odbyła się in vitro. Ludzie pobrali część komórek macierzystych krwi, edytowali je za pomocą systemu CRISPR/Cas9, namnożyli i wstrzyknęli z powrotem pacjentom. Tylko w ciągu półtora roku udało im się osiągnąć półtorakrotny wzrost hemoglobiny u kilkudziesięciu pacjentów z tymi diagnozami. Dzięki czemu byli oni w stanie przerwać terapię transfuzji czerwonych krwinek i zrezygnować z leków przeciwbólowych. W 2020 r. terapia genowa przeciwko hemofilii została oficjalnie uznana za skuteczną.

Terapia CRISP-Cas
Terapia CRISPR-Cas w leczeniu raka jest nadal w fazie I i II badań klinicznych, a technologia ta wykazuje zarówno pozytywne, jak i zerowe efekty. Amerykańscy biolodzy i onkolodzy badali mutacje w komórkach nowotworowych pacjentów i każdy z nich opracował unikalny i bezpieczny lek – specjalne antygeny, które nie są produkowane w komórkach pacjenta. Prace te trwały dziewięć miesięcy. Naukowcy poinformowali w swoim artykule w Nature, że spośród 16 pacjentów. Którzy przeszli pierwszą fazę testów leku opartego na limfocytach T z receptorami specyficznymi dla antygenu, choroba ustabilizowała się (przestała się rozwijać) tylko u pięciu, podczas gdy reszta nadal postępowała.
CRISPR jest również wykorzystywany w celach eksperymentalnych do zabijania wirusa HIV. Do tej pory już trzech pacjentów zostało poddanych edycji genetycznej w celu wyleczenia HIV. Wyniki nie są jeszcze znane. Pacjenci biorący udział w badaniu przyjmowali leki antyretrowirusowe. Ale plan zakładał, że lekarze przestaną przyjmować te leki 12 tygodni po leczeniu edycją genów i sprawdzą, czy wirus wyzdrowiał. Czy nie – krok znany jako „przerwanie leczenia analitycznego”. Jeśli wirus nie powróci, może to oznaczać, że CRISPR zniszczył geny wirusa. W eksperymentach klinicznych na zwierzętach odsetek myszy, które zostały wyleczone z HIV przy użyciu edycji genomu, wynosił 40 procent.
Dziś jest oczywiście za wcześnie na podsumowanie wyników techniki. Która pojawiła się jako narzędzie w rękach człowieka zaledwie dziesięć lat temu. Wcześniej była rozwijana w bakteriach przez miliardy lat i działała skutecznie tylko przeciwko wirusom. Ponieważ bakterie nie miały innych wrogów. Sceptyczni naukowcy muszą pamiętać, że człowiek zapożyczył tę technikę jako małą technikę. Ale próbuje rozszerzyć ją na cały ogromny obszar inżynierii genetycznej, który ma wszelkie szanse na odniesienie sukcesu w naszym stuleciu. Miliardy lat nie będą musiały czekać.
